引言 在上一期的东南亚医疗器械注册专题中,我们为大家详细介绍了马来西亚医疗器械注册的相关内容,得到了粉丝朋友们的广泛关注与好评。那么本期我们继续聚焦印度尼西亚医疗器械市场,为大家梳理印尼医疗器械注册的核心流程及注意事项。
PART 01 法规框架
印度尼西亚医疗器械监管机构为卫生部(Ministry of Health, MoH)下属国家食品药物管理局(National Agency of Drug and Food Control, NADFC),其马来语为Badan Pengawas Obat dan Makanan,故亦简称BPOM,主要负责监管和管理医疗器械的注册、市场准入、质量控制和监督等事务。
其法规要求有ASEAN Medical Devices Directive(AMDD)《东南亚国家医疗器械指令》及Regulation of the Minister of Health of The Republic of Indonesia Number 62 of 2017 on Product License of Medical Devices and Household Health Products《印度尼西亚共和国卫生部长关于医疗器保健品产品许可证的2017年第62号条例》等。
PART 02 分类规则
印尼的分类规则与马来西亚类似,根据风险由低到高,将医疗器械产品分为 A、B、C、D 四个等级(体外诊断试剂也一样),具体可参考当局文件Pedoman Klasifikasi医疗器械分类指南,也可以使用BPOM的在线分类数据库确认具体产品的类别。
PART 03 注册申请流程
在印度尼西亚注册医疗器械,公司必须首先获得IDAK (Izin Dibusi Alat Kesehatan) 或医疗器械分销许可证MDDL(Medical Device Distributor License)。IDAK/MDDC 可以通过在线授权平台申请,一旦获得批准,将通过Online Single Submission(OSS)网站发布。
目前,只有印尼本地公司可以申请IDAK/MDDL。也就是说,国内企业假如没有在当地注册公司的打算,那就需要指定当地授权代表(跟马来西亚一样)。总的来说,国内企业在印尼申请医疗器械注册的流程大致如下:确认产品类别→任命授权代表→授权代表获得经销商许可证书→注册申请(授权代表提交)→缴费→资料评审→获得注册证(有效期为5年)。大致费用及周期如下:
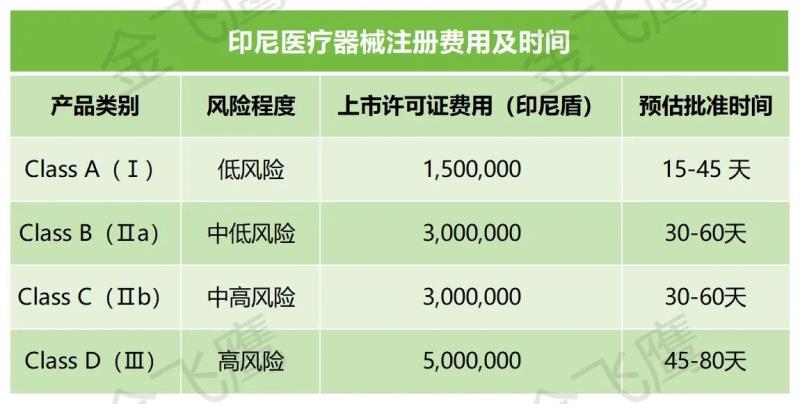
另外,与马来西亚一样,印尼医疗器械注册技术文件的要求可以参考东盟共同提交档案模板(CSDT)。对产品标签和使用说明书的要求也是一样,必须用印尼语,包括产品名称、型号、制造商信息、有效期、使用说明和警告等。注册资料可同时提供英语和印尼语版本。
PART 04 关于当地授权代表
印尼当地代表法规术语为Sole Agent/Sole Distributor/Exclusive Distributor,外国制造商必须在印尼指定当地实体公司为授权代表,属于独代性质。
资质要求:当地企业识别号NIB(Nomor Induk Berusana)、医疗器械分销证书IDAK或MDDL、好的分销管理符合性证明CDAKB(自2020年起强制要求)。
' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E)
以上就是我们本期分享的有关印度尼西亚注册相关内容,接下来还会继续东南亚医疗器械注册专题分享(下期预告:越南),记得持续关注哦~假如您有东南亚注册相关需求,欢迎随时致电咨询400-888-7587!
当然,假如您有其他国内外医疗器械注册认证需求,也欢迎随时咨询!我们的业务范围包括但不限于:国内外医疗器械(包含有源、无源、植入、无菌、义齿、IVD)注册、进口医疗器械注册、许可备案、体系辅导、企业培训等,国内外医疗器械注册一站式服务,请认准金飞鹰!
在上一期的东南亚医疗器械注册专题中,我们为大家详细介绍了马来西亚医疗器械注册的相关内容,得到了粉丝朋友们的广泛关注与好评。那么本期我们继续聚焦印度尼西亚医疗器械市场,为大家梳理印尼医疗器械注册的核心流程及注意事项。
印度尼西亚医疗器械监管机构为卫生部(Ministry of Health, MoH)下属国家食品药物管理局(National Agency of Drug and Food Control, NADFC),其马来语为Badan Pengawas Obat dan Makanan,故亦简称BPOM,主要负责监管和管理医疗器械的注册、市场准入、质量控制和监督等事务。
其法规要求有ASEAN Medical Devices Directive(AMDD)《东南亚国家医疗器械指令》及Regulation of the Minister of Health of The Republic of Indonesia Number 62 of 2017 on Product License of Medical Devices and Household Health Products《印度尼西亚共和国卫生部长关于医疗器保健品产品许可证的2017年第62号条例》等。
印尼的分类规则与马来西亚类似,根据风险由低到高,将医疗器械产品分为 A、B、C、D 四个等级(体外诊断试剂也一样),具体可参考当局文件Pedoman Klasifikasi医疗器械分类指南,也可以使用BPOM的在线分类数据库确认具体产品的类别。
在印度尼西亚注册医疗器械,公司必须首先获得IDAK (Izin Dibusi Alat Kesehatan) 或医疗器械分销许可证MDDL(Medical Device Distributor License)。IDAK/MDDC 可以通过在线授权平台申请,一旦获得批准,将通过Online Single Submission(OSS)网站发布。
目前,只有印尼本地公司可以申请IDAK/MDDL。也就是说,国内企业假如没有在当地注册公司的打算,那就需要指定当地授权代表(跟马来西亚一样)。总的来说,国内企业在印尼申请医疗器械注册的流程大致如下:确认产品类别→任命授权代表→授权代表获得经销商许可证书→注册申请(授权代表提交)→缴费→资料评审→获得注册证(有效期为5年)。大致费用及周期如下:

另外,与马来西亚一样,印尼医疗器械注册技术文件的要求可以参考东盟共同提交档案模板(CSDT)。对产品标签和使用说明书的要求也是一样,必须用印尼语,包括产品名称、型号、制造商信息、有效期、使用说明和警告等。注册资料可同时提供英语和印尼语版本。
印尼当地代表法规术语为Sole Agent/Sole Distributor/Exclusive Distributor,外国制造商必须在印尼指定当地实体公司为授权代表,属于独代性质。
资质要求:当地企业识别号NIB(Nomor Induk Berusana)、医疗器械分销证书IDAK或MDDL、好的分销管理符合性证明CDAKB(自2020年起强制要求)。
以上就是我们本期分享的有关印度尼西亚注册相关内容,接下来还会继续东南亚医疗器械注册专题分享(下期预告:越南),记得持续关注哦~假如您有东南亚注册相关需求,欢迎随时致电咨询400-888-7587!
当然,假如您有其他国内外医疗器械注册认证需求,也欢迎随时咨询!我们的业务范围包括但不限于:国内外医疗器械(包含有源、无源、植入、无菌、义齿、IVD)注册、进口医疗器械注册、许可备案、体系辅导、企业培训等,国内外医疗器械注册一站式服务,请认准金飞鹰!
' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E)
金飞鹰介绍
金飞鹰是国内领先的医疗器械一站式注册认证咨询与软件开发管理综合性服务集团公司,成立于2007年。集团总部位于深圳南山,并先后在广州、四川、湖南、江苏、广西、湖北、重庆等多地设立分支机构及办事处。
集团以“诚信、务实、专业、专注”的服务理念,为国内&国外医疗器械研发者、生产者、经营者、使用者提供从产品立项、设计开发、厂房选址、厂房平面布局规划、洁净厂房设计规划、企业硬件配置、设备选型、配置到人力资源组建、产品技术要求制定、检验检测辅导跟踪、临床评价、临床试验、质量管理体系(GMP、GSP、GB/T 42061、ISO 13485、QSR 820、MDSAP多国认证等)建立、运行、审核、获证的“全方位、一站式”医疗器械产业专业解决方案。
金飞鹰在美容类医疗器械产品领域积累了丰富的国内外注册/认证辅导经验,主要包括有源产品中的激光、强脉冲光(IPL、DPL、牛奶光)、红蓝紫光、RF射频、超声、中低频电刺激及电子助推装置类等;无源产品中的医用重组型胶原蛋白、透明质酸钠、无针注射器、液体成膜敷料类等;服务区域包括国内注册/进口注册,美国FDA、欧盟CE认证、英国UKCA、加拿大MDL/MDEL、澳大利亚、巴西、沙特、日本、韩国、东南亚等国外注册
金飞鹰是国内领先的医疗器械一站式注册认证咨询与软件开发管理综合性服务集团公司,成立于2007年。集团总部位于深圳南山,并先后在广州、四川、湖南、江苏、广西、湖北、重庆等多地设立分支机构及办事处。
集团以“诚信、务实、专业、专注”的服务理念,为国内&国外医疗器械研发者、生产者、经营者、使用者提供从产品立项、设计开发、厂房选址、厂房平面布局规划、洁净厂房设计规划、企业硬件配置、设备选型、配置到人力资源组建、产品技术要求制定、检验检测辅导跟踪、临床评价、临床试验、质量管理体系(GMP、GSP、GB/T 42061、ISO 13485、QSR 820、MDSAP多国认证等)建立、运行、审核、获证的“全方位、一站式”医疗器械产业专业解决方案。
金飞鹰在美容类医疗器械产品领域积累了丰富的国内外注册/认证辅导经验,主要包括有源产品中的激光、强脉冲光(IPL、DPL、牛奶光)、红蓝紫光、RF射频、超声、中低频电刺激及电子助推装置类等;无源产品中的医用重组型胶原蛋白、透明质酸钠、无针注射器、液体成膜敷料类等;服务区域包括国内注册/进口注册,美国FDA、欧盟CE认证、英国UKCA、加拿大MDL/MDEL、澳大利亚、巴西、沙特、日本、韩国、东南亚等国外注册
往期精彩推荐 # # # # # #
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139


