引言 近期东南亚医疗器械注册热度持续攀升,前几天我们在“金飞鹰药械技术咨询集团”公众号陆续分享了马来西亚和印度尼西亚注册的相关内容,得到了粉丝朋友们的广泛关注,本期文章继续聚焦越南医疗器械市场,帮大家简单梳理一下越南医疗器械注册的关键流程及相关注意事项。
PART 01 法规框架
越南医疗器械监管机构为Department of Medical Equipment and Construction(DMEC) under Ministry of Health(MoH)卫生部所属的医疗设备和建设部,其主要职责是:负责审核、批准医疗器械的注册和监管,确保医疗器械在越南市场上符合安全性和有效性要求。
越南医疗器械注册涉及到的主要法规有Decree No. 98/2021/ND-CPND-CP Decree on management of medical equipment《医疗器械监管法令(2021年第98号)》及Decree No.07/2023/ND-CPA mending and supplementing a number of article of Decree No. 98/2021《对2021年98号医疗器械监管法的补充法令(2023年第7号)》等。
PART 02 分类规则
越南的分类规则与马来西亚及印尼类似,遵循 GHTF 医疗器械分类指南,根据风险由低到高,将医疗器械产品分为 A、B、C、D 四个等级(体外诊断试剂也一样),越南卫生部在2022年发布的有关医疗器械监管法令实施细则里明确了医疗器械的16条分类规则及体外诊断医疗器械的7条分类规则。
PART 03 产品准入路径
在越南,A类和B类器械需获得适用标准通知,C类和D类器械需获得流通注册证书(产品许可证),越南境外企业需指定当地授权代表进行相关操作。
针对A类和B类器械,越南当地授权代表需提交Declaration of Applied Standards application(适用标准的声明)到授权代表所在的省级卫生局,以获取营销授权码Marketing Authorization Code(MAC)。得到批准后,卫生局将发布适用标准通知,该通知具有终身有效性。
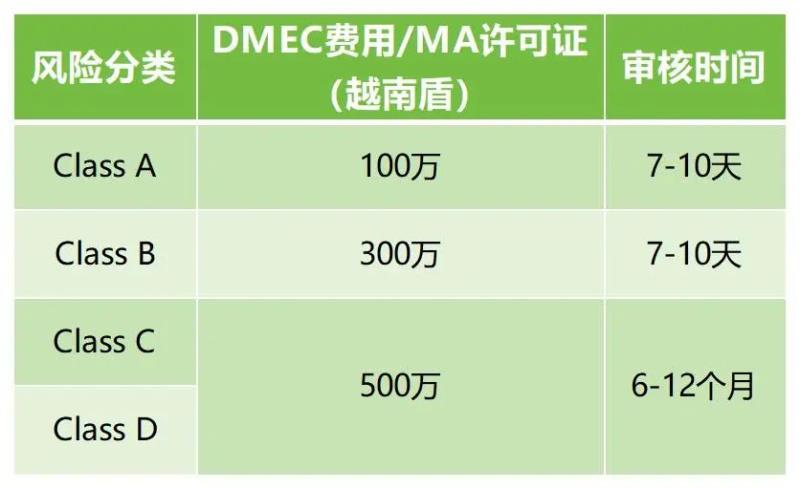
C类和D类器械在越南进口和销售之前需要获得市场授权(MA)许可证;当地授权代表需要提交上市注册文档Marketing Authorization Registration到卫生部DMEC,审核和批准后获得永久有效的《流通注册证》(产品许可证)。大致费用及周期如下:
PART 04 有关快速审查
在越南申请医疗器械注册,是有快速审查路径的。已获得下列组织或国家之一的自由销售证书或上市认证,在越南可适用快速审查流程:
美国食品药品监督管理局FDA
澳大利亚药品管理局TGA
加拿大卫生部HC
日本厚生劳动省MHLW或日本药品医疗器械管理PMDA
欧盟(EU)
英国MHRA
中国国家药品监督管理局NMPA
韩国食品药品安全管理部MFDS
' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E)
以上就是我们本期分享的有关越南注册相关内容,接下来还会继续东南亚医疗器械注册专题分享,记得持续关注哦~假如您有东南亚注册相关需求,欢迎随时致电咨询400-888-7587!
当然,假如您有其他国内外医疗器械注册认证需求,也欢迎随时咨询!我们的业务范围包括但不限于:国内外医疗器械(包含有源、无源、植入、无菌、义齿、IVD)注册、进口医疗器械注册、许可备案、体系辅导、企业培训等,国内外医疗器械注册一站式服务,请认准金飞鹰!
越南医疗器械监管机构为Department of Medical Equipment and Construction(DMEC) under Ministry of Health(MoH)卫生部所属的医疗设备和建设部,其主要职责是:负责审核、批准医疗器械的注册和监管,确保医疗器械在越南市场上符合安全性和有效性要求。
越南医疗器械注册涉及到的主要法规有Decree No. 98/2021/ND-CPND-CP Decree on management of medical equipment《医疗器械监管法令(2021年第98号)》及Decree No.07/2023/ND-CPA mending and supplementing a number of article of Decree No. 98/2021《对2021年98号医疗器械监管法的补充法令(2023年第7号)》等。
越南的分类规则与马来西亚及印尼类似,遵循 GHTF 医疗器械分类指南,根据风险由低到高,将医疗器械产品分为 A、B、C、D 四个等级(体外诊断试剂也一样),越南卫生部在2022年发布的有关医疗器械监管法令实施细则里明确了医疗器械的16条分类规则及体外诊断医疗器械的7条分类规则。
在越南,A类和B类器械需获得适用标准通知,C类和D类器械需获得流通注册证书(产品许可证),越南境外企业需指定当地授权代表进行相关操作。
针对A类和B类器械,越南当地授权代表需提交Declaration of Applied Standards application(适用标准的声明)到授权代表所在的省级卫生局,以获取营销授权码Marketing Authorization Code(MAC)。得到批准后,卫生局将发布适用标准通知,该通知具有终身有效性。
C类和D类器械在越南进口和销售之前需要获得市场授权(MA)许可证;当地授权代表需要提交上市注册文档Marketing Authorization Registration到卫生部DMEC,审核和批准后获得永久有效的《流通注册证》(产品许可证)。大致费用及周期如下:

在越南申请医疗器械注册,是有快速审查路径的。已获得下列组织或国家之一的自由销售证书或上市认证,在越南可适用快速审查流程:
美国食品药品监督管理局FDA
澳大利亚药品管理局TGA
加拿大卫生部HC
日本厚生劳动省MHLW或日本药品医疗器械管理PMDA
欧盟(EU)
英国MHRA
中国国家药品监督管理局NMPA
韩国食品药品安全管理部MFDS
以上就是我们本期分享的有关越南注册相关内容,接下来还会继续东南亚医疗器械注册专题分享,记得持续关注哦~假如您有东南亚注册相关需求,欢迎随时致电咨询400-888-7587!
当然,假如您有其他国内外医疗器械注册认证需求,也欢迎随时咨询!我们的业务范围包括但不限于:国内外医疗器械(包含有源、无源、植入、无菌、义齿、IVD)注册、进口医疗器械注册、许可备案、体系辅导、企业培训等,国内外医疗器械注册一站式服务,请认准金飞鹰!
' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E)
金飞鹰介绍
金飞鹰是国内领先的医疗器械一站式注册认证咨询与软件开发管理综合性服务集团公司,成立于2007年。集团总部位于深圳南山,并先后在广州、四川、湖南、江苏、广西、湖北、重庆等多地设立分支机构及办事处。
集团以“诚信、务实、专业、专注”的服务理念,为国内&国外医疗器械研发者、生产者、经营者、使用者提供从产品立项、设计开发、厂房选址、厂房平面布局规划、洁净厂房设计规划、企业硬件配置、设备选型、配置到人力资源组建、产品技术要求制定、检验检测辅导跟踪、临床评价、临床试验、质量管理体系(GMP、GSP、GB/T 42061、ISO 13485、QSR 820、MDSAP多国认证等)建立、运行、审核、获证的“全方位、一站式”医疗器械产业专业解决方案。
金飞鹰在美容类医疗器械产品领域积累了丰富的国内外注册/认证辅导经验,主要包括有源产品中的激光、强脉冲光(IPL、DPL、牛奶光)、红蓝紫光、RF射频、超声、中低频电刺激及电子助推装置类等;无源产品中的医用重组型胶原蛋白、透明质酸钠、无针注射器、液体成膜敷料类等;服务区域包括国内注册/进口注册,美国FDA、欧盟CE认证、英国UKCA、加拿大MDL/MDEL、澳大利亚、巴西、沙特、日本、韩国、东南亚等国外注册。,时02:07
金飞鹰是国内领先的医疗器械一站式注册认证咨询与软件开发管理综合性服务集团公司,成立于2007年。集团总部位于深圳南山,并先后在广州、四川、湖南、江苏、广西、湖北、重庆等多地设立分支机构及办事处。
集团以“诚信、务实、专业、专注”的服务理念,为国内&国外医疗器械研发者、生产者、经营者、使用者提供从产品立项、设计开发、厂房选址、厂房平面布局规划、洁净厂房设计规划、企业硬件配置、设备选型、配置到人力资源组建、产品技术要求制定、检验检测辅导跟踪、临床评价、临床试验、质量管理体系(GMP、GSP、GB/T 42061、ISO 13485、QSR 820、MDSAP多国认证等)建立、运行、审核、获证的“全方位、一站式”医疗器械产业专业解决方案。
金飞鹰在美容类医疗器械产品领域积累了丰富的国内外注册/认证辅导经验,主要包括有源产品中的激光、强脉冲光(IPL、DPL、牛奶光)、红蓝紫光、RF射频、超声、中低频电刺激及电子助推装置类等;无源产品中的医用重组型胶原蛋白、透明质酸钠、无针注射器、液体成膜敷料类等;服务区域包括国内注册/进口注册,美国FDA、欧盟CE认证、英国UKCA、加拿大MDL/MDEL、澳大利亚、巴西、沙特、日本、韩国、东南亚等国外注册。,时02:07
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139


