相较于其他欧美国家来说,中国的助听器产业起步较晚且助听器产品的渗透率较低,但随着人口老龄化加剧及大众消费水平的提升,中国助听器市场的需求逐步被激发,近年来一直保持着持续增长的态势。
前段时间,我们跟大家分享过助听器取证案例,11月30日,金飞鹰又辅导广东一家企业成功取得耳内式助听器的国内 Ⅱ 类医疗器械注册证,详见下图☟

当然,此前我们还辅导不少客户完成了助听器的美国 Ⅰ 类产品列名及510(k)号申请,今天咱们就来聊一聊助听器在中国和美国注册的相关事项。
按传导方式,助听器可分为气导式助听器、骨导式助听器,目前大部分助听器都是气导式助听器。骨导助听器则一般适用于外耳道闭锁、狭窄等患者,或者中耳有先天畸形、慢性化脓性中耳炎反复化脓、传导性听力损失程度比较大、一般气导助听器无效的患者。二者在我国都是 Ⅱ 类医疗器械,分类编码19-01-07。
事实上,还有一种植入式骨导助听器,在我国则属于 Ⅲ 类医疗器械。

▵ 分类目录中“助听器”的搜索结果
本次注册证上的适用范围:“供气导性听力损失患者补偿听力用”,很明显,这是一款气导式助听器。
在美国,助听器的分类则分为 Ⅰ 类和 Ⅱ 类两种。普通气导助听器为 Ⅰ 类产品,只需做产品列名(Listing);Ⅱ 类产品中,带有无线技术的气导助听器是510(k)豁免的,其他分类(包括气导、骨导及植入式骨导)则都需取得510(k)号。
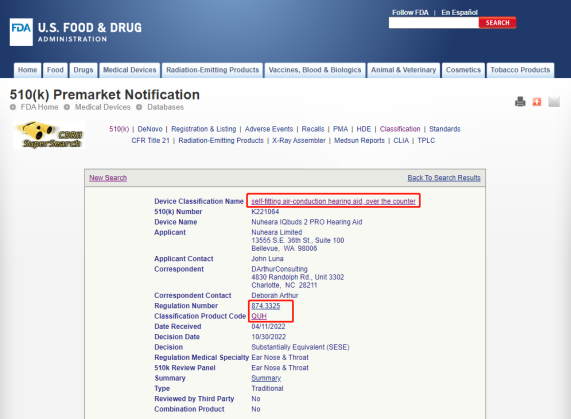
值得注意的是,美国FDA于10月更新了有关助听器的监管规则,新增了OTC类别,包含三个产品代码:QUF,QUG,QUH。这些OTC类别助听器适用于某些18岁及以上的患有轻至中度听力损失患者使用的气导型助听器,使得他们可以在商店或网上购买助听器,而无需先找医生进行检查,或找听力专家进行规格测试。
这其中,QUF,QUG这两个代码的产品是510(k)豁免的,而QUH(即自适配空气传导助听器,非处方)则需要申请510(k)方能上市。
假如您有助听器出口美国的需求,那么以下重点请记牢啦:
2022年10月17日前尚未出售的助听器,如有涉及到法规变化的,需要按新的监管要求获得许可方能上市销售。比如,在无线空气传导助听器中添加自适配技术,且在美国时间2022年10月17日或之后销售该器械,需获批510(k);
2022年10月17日前已合法出售的助听器,则必须在美国时间2023年4月14日前达到适用助听器的新的或修订的要求。
如前文所述,金飞鹰在助听器产品国内&美国注册方面积累了众多案例,欢迎广大助听器生产企业前来咨询! 当然,假如您有其他医疗器械注册需求,也欢迎联系我们咨询!我们的业务范围包括但不限于:国内外医疗器械(包含有源、无源、植入、无菌、义齿、IVD、软件)注册、进口医疗器械注册、许可备案、体系辅导、企业培训、软件开发等,国内外医疗器械注册一站式服务,请认准金飞鹰! 医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295


