近年来,随着非洲国家的经济发展,民众对基础医疗服务的需求持续提升,各国政府对于医疗卫生的费用支出也持续增长,非洲医疗卫生市场规模正在不断扩大。目前非洲大部分国家缺乏本土医疗器械制造业,医疗器械进口依赖度高,这为我国医疗器械企业出海提供了良机。
与此同时,在“一带一路”倡议不断向非洲延伸以及中非“八大行动”不断落实的背景下,中国企业投资非洲医疗器械产业有望迎来更大机遇。
INTRODUCTION
在此背景下,本期文章我们聚焦西非经济的重要增长引擎——加纳,为大家带来加纳医疗器械注册全流程详解。
01
法规框架
医疗器械产品注册由加纳食品和药品管理局(Ghana FDA)严格把控。若想将医疗器械引入加纳市场,企业必须通过加纳FDA的认证流程。具体来说,加纳医疗器械注册的要求及流程主要参照以下法规和指南:
1)Public Health Act, 2012——《公共卫生法(2012)》
2)GUIDELINE FOR REGISTRATION OF MEDICAL DEVICE——《医疗器械注册指南》
3)GUIDELINE FOR IMPORTATION OF MEDICAL DEVICES——《医疗器械进口指南》
02
分类规则
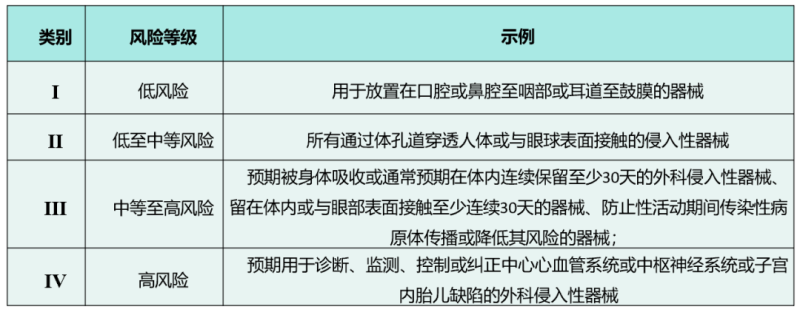
在《医疗器械注册指南》中,加纳FDA根据产品风险从低到高,将医疗器械分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个风险等级。下表列出了医疗器械的四个风险类别,企业可根据示例内容对产品类别进行大致判断。另外在《医疗器械注册指南》中,还列出了医疗器械分类的16条具体规则,根据这些规则可以更明确地判断产品类别。
03
注册递交路径及资料要求
在《医疗器械注册指南》中,没有对各产品类别的注册路径进行区分,而是只分为新的注册申请、注册续期的申请及已注册医疗器械的变更申请三种,注册时需提交的资料主要包括医疗器械注册申请表、技术文档(器械描述和功能、符合安全和性能基本原则的证据、器械规格、设计文件、器械验证和确认等)、质量管理体系文件、标签和使用说明书等。

04
关于加纳代理人
加纳境外申请人在加纳进行注册,必须指定当地代理人(local agent),具体要求如下:
1)资质要求:在加纳注册的法人团体;具备申请人的相关授权;有能力代表申请人处理与注册相关的事宜。
2)代理人职责:监控市场上的器械并承担法律责任,向加纳FDA通报相关问题;促进申请人与加纳FDA之间的沟通;处理器械召回;为用户提供技术支持和服务等。
' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E)
以上就是我们本期分享的加纳注册相关内容,假如您有加纳注册需求,欢迎随时联系我们~金飞鹰可为您提供以下专业服务:
注册全流程服务:产品分类评估和注册路径规划;资料准备、审核和递交;与加纳FDA直接沟通并及时响应客户问询;
本地化支持:依托加纳当地战略合作商资源,为企业提供专业代理人服务,并整合本土资源加速注册审批流程;
质量管理服务:基于ISO 13485要求的质量管理体系建立和辅导;迎检准备和现场支持;差距分析和整改建议;
持续合规服务:注册续期提醒和管理;法规变动预警;变更管理和申报。
近年来,随着非洲国家的经济发展,民众对基础医疗服务的需求持续提升,各国政府对于医疗卫生的费用支出也持续增长,非洲医疗卫生市场规模正在不断扩大。目前非洲大部分国家缺乏本土医疗器械制造业,医疗器械进口依赖度高,这为我国医疗器械企业出海提供了良机。
与此同时,在“一带一路”倡议不断向非洲延伸以及中非“八大行动”不断落实的背景下,中国企业投资非洲医疗器械产业有望迎来更大机遇。
在此背景下,本期文章我们聚焦西非经济的重要增长引擎——加纳,为大家带来加纳医疗器械注册全流程详解。
医疗器械产品注册由加纳食品和药品管理局(Ghana FDA)严格把控。若想将医疗器械引入加纳市场,企业必须通过加纳FDA的认证流程。具体来说,加纳医疗器械注册的要求及流程主要参照以下法规和指南:
1)Public Health Act, 2012——《公共卫生法(2012)》
2)GUIDELINE FOR REGISTRATION OF MEDICAL DEVICE——《医疗器械注册指南》
3)GUIDELINE FOR IMPORTATION OF MEDICAL DEVICES——《医疗器械进口指南》
在《医疗器械注册指南》中,加纳FDA根据产品风险从低到高,将医疗器械分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个风险等级。下表列出了医疗器械的四个风险类别,企业可根据示例内容对产品类别进行大致判断。另外在《医疗器械注册指南》中,还列出了医疗器械分类的16条具体规则,根据这些规则可以更明确地判断产品类别。

在《医疗器械注册指南》中,没有对各产品类别的注册路径进行区分,而是只分为新的注册申请、注册续期的申请及已注册医疗器械的变更申请三种,注册时需提交的资料主要包括医疗器械注册申请表、技术文档(器械描述和功能、符合安全和性能基本原则的证据、器械规格、设计文件、器械验证和确认等)、质量管理体系文件、标签和使用说明书等。

加纳境外申请人在加纳进行注册,必须指定当地代理人(local agent),具体要求如下:
1)资质要求:在加纳注册的法人团体;具备申请人的相关授权;有能力代表申请人处理与注册相关的事宜。
2)代理人职责:监控市场上的器械并承担法律责任,向加纳FDA通报相关问题;促进申请人与加纳FDA之间的沟通;处理器械召回;为用户提供技术支持和服务等。
以上就是我们本期分享的加纳注册相关内容,假如您有加纳注册需求,欢迎随时联系我们~金飞鹰可为您提供以下专业服务:
注册全流程服务:产品分类评估和注册路径规划;资料准备、审核和递交;与加纳FDA直接沟通并及时响应客户问询;
本地化支持:依托加纳当地战略合作商资源,为企业提供专业代理人服务,并整合本土资源加速注册审批流程;
质量管理服务:基于ISO 13485要求的质量管理体系建立和辅导;迎检准备和现场支持;差距分析和整改建议;
持续合规服务:注册续期提醒和管理;法规变动预警;变更管理和申报。
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139


