有关UDI的分阶段实施要求,澳大利亚TGA也明确了!
TGA在此前发布的Complying with the Unique Device Identification timeframes for medical devices中提到,TGA将在5年内引入UDI:首先是高风险医疗器械的合规性,然后是低风险设备的合规性。

当然,对此也给出了过渡期:在UDI监管框架生效(2025年3月24日)与设备UDI合规性开始日期之间的时间段,企业可以:
内部做好准备
准备设备标签和包装
准备 UDI-DI 和相关数据
选择并测试向澳大利亚 UDI 数据库 (AusUDID) 提交数据的方法
过渡期期间,企业可以自愿选择让设备满足UDI要求。
以下为该指南文件中MD及IVD的UDI具体实施要求:
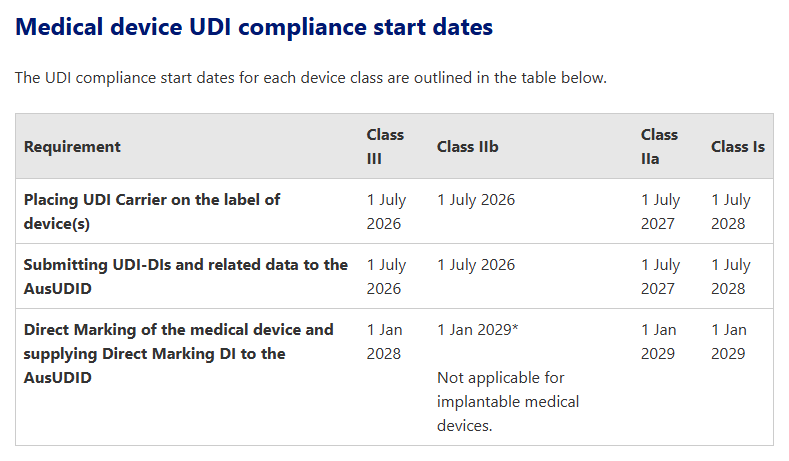
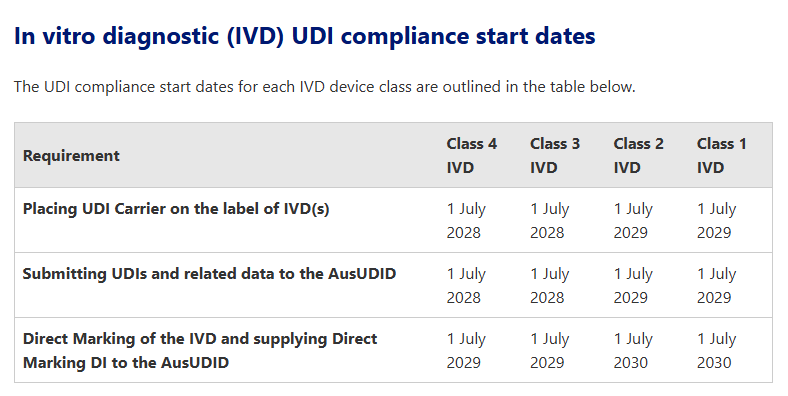
这其中,最早实施UDI的为Ⅲ类及Ⅱb类医疗器械,需要在2026年7月1日起将UDI载体放在设备标签上及向AusUDID 提交 UDI-DI 和相关数据,最晚的则是1类和2类IVD,需要在2030年1月1日完成有关UDI的所有操作。
以上仅对部分内容进行摘录,更多详细信息,可点击文末“阅读原文”查看。

TGA在此前发布的Complying with the Unique Device Identification timeframes for medical devices中提到,TGA将在5年内引入UDI:首先是高风险医疗器械的合规性,然后是低风险设备的合规性。

当然,对此也给出了过渡期:在UDI监管框架生效(2025年3月24日)与设备UDI合规性开始日期之间的时间段,企业可以:
内部做好准备
准备设备标签和包装
准备 UDI-DI 和相关数据
选择并测试向澳大利亚 UDI 数据库 (AusUDID) 提交数据的方法
过渡期期间,企业可以自愿选择让设备满足UDI要求。
以下为该指南文件中MD及IVD的UDI具体实施要求:


这其中,最早实施UDI的为Ⅲ类及Ⅱb类医疗器械,需要在2026年7月1日起将UDI载体放在设备标签上及向AusUDID 提交 UDI-DI 和相关数据,最晚的则是1类和2类IVD,需要在2030年1月1日完成有关UDI的所有操作。
以上仅对部分内容进行摘录,更多详细信息,可点击文末“阅读原文”查看。
往期精彩推荐
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139


