近日,国家药监局正式发布2025年版《医疗器械生产质量管理规范》,标志着我国医疗器械生产监管进入全新阶段。与2014版相比,新版规范在结构、理念、内容上均实现全面升级,对企业质量管理体系提出更高、更细、更严的要求。
本文将带您快速梳理2025版与2014版的核心差异,助力企业提前布局、合规发展。
一、整体理念:从“有”到“优”,体系全面升级
2025版规范共15章132条,相比2014版的13章84条,不仅在结构上更加完整,更在理念上实现三大升级:
体系化:质量保证不再分散,而是系统化、闭环化;
全程化:覆盖从设计开发到售后服务的全生命周期;
精准化:针对UDI、电子数据、委托生产等新业态提出明确要求。
二、新增三大章节,补齐监管短板
新版规范首次独立设立以下三章,系统性强化关键环节:
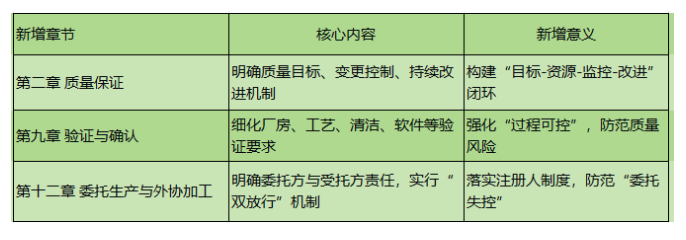
三、人员资质:要求更具体、更严格
2025版对关键岗位人员的学历、职称、工作经验提出明确量化要求,杜绝“挂名”现象:
管理者代表(二/三类):本科及以上学历或中级职称 + 3年以上经验
质量部门负责人(二/三类):本科 + 中级职称 + 3年以上经验
生产部门负责人:专科及以上 + 3年以上经验
四、文件与数据管理:迎接数字化监管时代
新版将“数据管理”提升至与“文件管理”同等重要地位,明确:
电子记录、电子签名、数据备份等信息化要求;
建立偏差处理程序,清场管理纳入批记录;
记录保存期不少于2年,且与产品寿命期一致。
五、设计开发与生产追溯:控制前移、全程可溯
设计开发:强调“设计转换”,确保从实验室到生产的稳定性;
委托设计:明确委托方评估与管理责任;
UDI实施:强制推行医疗器械唯一标识,实现全流程追溯。
六、委托生产:权责清晰,“双放行”不可委托
2025版首次明确:
委托方对产品全生命周期质量负总责;
受托方对生产过程负责;
上市放行由委托方执行,不得委托。
七、分析与改进:形成质量管理闭环
新版将投诉、不良事件、CAPA、召回、内审、管理评审整合为独立章节,强调数据驱动的持续改进机制,推动企业实现自我完善。
总结:企业应如何应对?
2025版规范的发布,是对医疗器械企业质量管理能力的一次“大考”。企业应尽快:
(1)对标自查,识别现有体系与新版要求的差距;
(2)强化人员配置,确保关键岗位符合资质;
(3)完善数据与文件系统,适应数字化监管;
(4)梳理委托生产流程,明确双方权责;
(5)建立全生命周期质量管理机制,实现持续改进。
温馨提示:
本文仅为差异要点解读,具体执行请以官方正式发布的《医疗器械生产质量管理规范(2025年版)》全文为准。
如需获取完整版规范或专业合规咨询,欢迎在评论区留言或私信联系我们!
信息来源:国家药监局
排版整理:金飞鹰药械



