2025年11月27日,欧盟委员会在官方公报上发布Commission Decision (EU) 2025/2371决议,正式确认EUDAMED数据库中首批四个核心模块已达到完全功能规范要求。这一公告标志着欧盟医疗器械监管数字化迈入实质性落地阶段。根据决议,从2025年11月27日起的6个月过渡期结束后,即2026年5月28日,这些模块的使用将从自愿转为强制性法律义务。
01 欧盟EUDAMED分步实施策略正式落地
EUDAMED数据库是欧盟医疗器械法规(MDR)和体外诊断器械法规(IVDR)的核心组成部分。该系统原计划作为一个整体一次性上线,但因开发复杂度高而调整为成熟一个,上线一个的渐进式实施策略。2024年6月通过的欧盟条例2024/1860为这一分步走策略提供了法律基础,允许每个模块在独立完成审计并宣布功能齐全后,便可单独投入强制使用。本次决议正是这一策略下的首个里程碑,意味着EUDAMED实施进入了最后的 “强制倒计时”阶段。
02 四大核心模块的功能解析
首批强制实施的四个模块构成了EUDAMED系统的“基础骨架”,解决了“谁在卖”、“卖什么”以及“是否有证”的核心透明度问题。
经济运营商注册模块(Actor Registration)
所有在欧盟市场运营的医疗器械制造商、授权代表和进口商必须在此模块完成注册,并获得单一注册号(SRN),该号码将作为其在所有欧盟官方文件中的唯一身份标识。
UDI/器械注册模块(UDI/Device Registration)
制造商必须在此模块中注册所有投放欧盟市场的医疗器械(定制器械除外)。注册需要提供详细的产品信息,包括Basic UDI-DI、器械风险等级、商品名、型号、UDI详细信息(UDI-DI、UDI-PI)以及欧洲医疗器械命名(EMDN)代码等。
公告机构和证书模块(Notified Bodies & Certificates)
此模块集中管理所有在欧盟境内运营的公告机构信息及其颁发的证书数据,提高监管透明度和证书可追溯性。
市场监督模块(Market Surveillance)
该模块旨在加强欧盟市场监督机构之间的信息交流,便于对不符合要求的医疗器械采取协调一致的市场监管措施。
03 “6-12-18”黄金时间表:企业合规倒计时
针对已启用的四大模块,根据Regulation (EU) 2024/1860的修正案,合规义务按照T(2025年11月27日)为基准点,分三个关键节点落地。
节点一:T+6个月(2026年5月28日)
含义:EUDAMED正式成为MDR/IVDR的法定合规环境。从这一天起,所有涉及这四个模块的新增合规动作(如新申请SRN)必须在系统中进行。
节点二:T+12个月(2026年11月27日)
核心义务:这是一个硬性死线。在此日期前,制造商必须确保所有正在投放市场的器械(包括MDR/IVDR证书器械以及利用过渡期的Legacy Devices)在EUDAMED中完成注册。
警告:逾期未注册的器械,可能面临被海关扣留或被勒令停止销售的风险。
节点三:T+18个月(2027年5月27日)
里程碑:公告机构完成MDR/IVDR证书及SSCP上传
核心义务:公告机构必须在此日期前将有效的CE证书以及III类/植入式器械的SSCP(安全与临床性能总结)上传至EUDAMED供公众查询。
04 遗留器械与定制器械的特殊要求
对于遗留器械,虽然大多数MDR/IVDR要求不适用,但必须在EUDAMED中完成注册。没有Basic UDI或UDI-DI时,可使用虚拟UDI完成注册。定制器械根据MDR第29、30和31条,可豁免在UDI/器械模块中的注册要求。但定制器械制造商的注册要求可能变得更复杂,可能需要根据各成员国要求向主管当局提交清单。
05 IVDR制造商同样适用,切勿心存侥幸
特别需要提醒的是,IVD制造商切勿心存侥幸。本次强制倒计时同样适用于IVDR下的体外诊断器械。根据决议及IVDR Article 113(3),EUDAMED是MDR和IVDR共用的数据库系统。本次决议确认验收合格的四个模块,同时也涵盖了IVDR Article 30(2)所列出的对应电子系统。因此,无论产品是依据IVDD指令的遗留器械,还是已经获得IVDR证书的新器械,都需要在2026年11月27日这一截止日期前完成SRN注册、UDI/器械数据录入和证书信息核对。
06 企业应对策略:立即行动,勿拖延
行业专家强调,企业不应低估EUDAMED准备的复杂性。EirMed公司CEO Richard Houlihan指出:“EUDAMED是一个项目,需要时间来准备。不要等到最后一分钟,届时帮助您理解EUDAMED复杂性的资源可能已经不够用了。”
2025年12月-2026年3月:收集并准备所有上市器械的注册数据
2026年4月-5月:完成EUDAMED中的数据上传工作
2026年5月28日起:确保四大模块正式强制使用后,相关注册和申报依法进行
07 未来展望:剩余模块的实施安排
随着首批四个模块的实施尘埃落定,行业关注点将转向剩余两个模块的实施时间表:临床调查/性能研究模块和警戒系统模块。根据相关讨论,警戒模块预计将在2026年第4季度发布Notice,预计将于2027年第2季度正式转为强制。目前仍然继续沿用当前的过渡方案(MIR表格+邮件/国家门户)。临床调查/性能研究模块目前仍然处于开发阶段,当前仍需要继续遵循各成员国的国家要求。EUDAMED四大模块的强制实施标志着欧盟医疗器械监管向着更高透明度、更强可追溯性和更严监管的目标迈出了关键一步。对医疗器械企业而言,数字化合规时代已正式开启,抓紧最后6个月的窗口期,完成数据的清理与迁移,才是应对这一监管变革的明智之举。立即行动,切勿拖延——这是所有医疗器械制造商面对EUDAMED强制合规倒计时的唯一选择。金飞鹰UDI管理软件:核心功能,直击政策刚需
1. 一键生成全球合规编码
支持多国标准:内置中国NMPA、美国FDA、欧盟MDR、加拿大等法规要求,自动识别地区码并转换;
智能赋码:输入产品批号/序列号规则,系统自动生成一维码、二维码或RFID标签,避免人工编码错误;
DI+PI动态组合:设备标识符(DI)与生产标识符(PI)实时绑定,确保唯一性。
2. 全流程追溯,满足监管“零容忍”
三级追溯体系:从生产计划、打印工单、再到打印记录,全程数据可溯源;
审计留痕:所有操作记录(如标签打印、数据修改、报废补打等)自动存档,支持监管部门随时调取。
3. 硬件无缝对接
兼容主流设备:与扫码枪、PDA、工业读码器等硬件互通,生产线上实时扫码录入数据;
多设备协同:支持多台硬件同时作业,提升数据采集效率,减少人工干预。
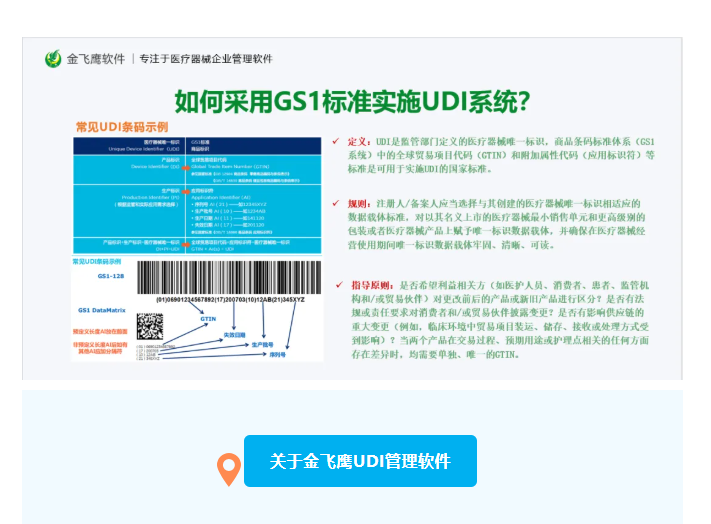
金飞鹰UDI管理软件——让医疗器械唯一标识实施更简单、更高效、更安全!
信息来源:欧洲联盟
排版整理:金飞鹰药械